近日,代谢工程领域权威期刊《代谢工程》(Metabolic Engineering)在线发表了我校生物工程学院阿华生物工程研究所蔡孟浩副教授的最新研究成果。
基于合成生物学技术,利用酵母底盘细胞异源合成高附加值药物分子(如聚酮、萜类、黄酮、生物碱等)已成为全球研究热点并展现出了巨大的应用潜力。但酵母细胞中药物合成前体乙酰辅酶A的分区分布及含量不足常使目标产物合成能力受限。该研究发现了甲基营养型毕赤酵母(Komagataella phaffii)具有强力的乙醇同化能力,这与常规酵母易通过葡萄糖效应生产积累乙醇极为不同。而乙醇在细胞质中经三步代谢直接产生乙酰辅酶A,将利于其衍生药物分子的合成。基于此,作者设计了乙醇诱导型(ESAD)及组成型(CSAD)转录调控信号放大器件,使乙醇诱导表达能力提升近20倍,并实现了葡萄糖阻遏/乙醇诱导的理想调控模式。研究人员将此器件用于合成降血脂药物辛伐他汀中间体莫纳克林J,以ESAD驱动上游合成途径,CSAD驱动下游合成途径,并偶联莫纳克林J竞争途径的阻断调控,最终实现酵母菌群反应器发酵生产莫纳克林J高达3.2g/L,且无副产物累积,具备工业应用前景。
辛伐他汀全球年销售额近30亿美元,其工业半合成中间体莫纳克林J主要通过土曲霉发酵生产洛伐他汀,再经高温、强碱水解而得。该研究为莫纳克林J的工业生产提供了新模式,有望降低生产及环保成本。
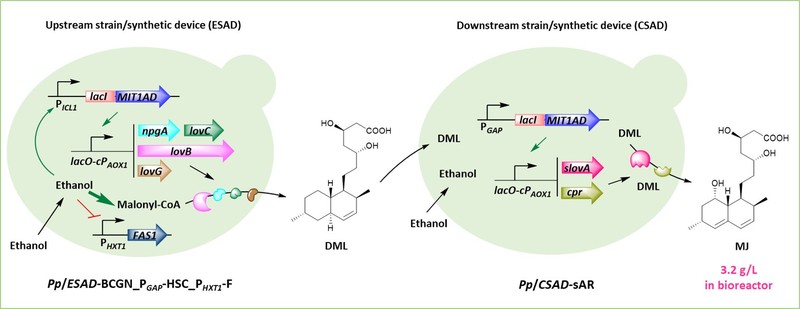
该研究深度开发了毕赤酵母底盘用于乙酰辅酶A衍生药物分子的生物合成,实现了乙醇作为碳源底物、合成前体、诱导剂的“三位一体”调控功能,对于丰富合成生物学底盘细胞及药物生物合成有重要意义。该研究所开发的相关底盘及设计策略也可用于其他医药、化工产品的合成。
该论文第一作者为刘一奇,通讯作者为蔡孟浩。该研究工作得到了阿华生物工程研究所张元兴教授团队的大力支持,并得到国家自然科学基金、上海市青年科技启明星计划、上海市科技创新行动计划基础研究领域项目合成生物学专项、国家“111”计划、中央高校基本科研业务费、生物反应器工程国家重点实验室面上基金的资助。
文章信息:
Engineered ethanol-driven biosynthetic system for improving production of acetyl-CoA derived drugs in Crabtree-negative yeast. Metabolic Engineering, DOI:10.1016/j.ymben. 2019.05.001。


