近日,我校生物工程学院和生物反应器工程国家重点实验室叶邦策教授团队在放线菌代谢调控与应用研究领域再次取得重要进展,相关研究成果以“Allosteric regulation by c-di-AMP modulates a complete N-acetylglucosaminesignaling cascade in Saccharopolyspora erythraea”为题,发表于国际知名学术期刊Nature Communications。
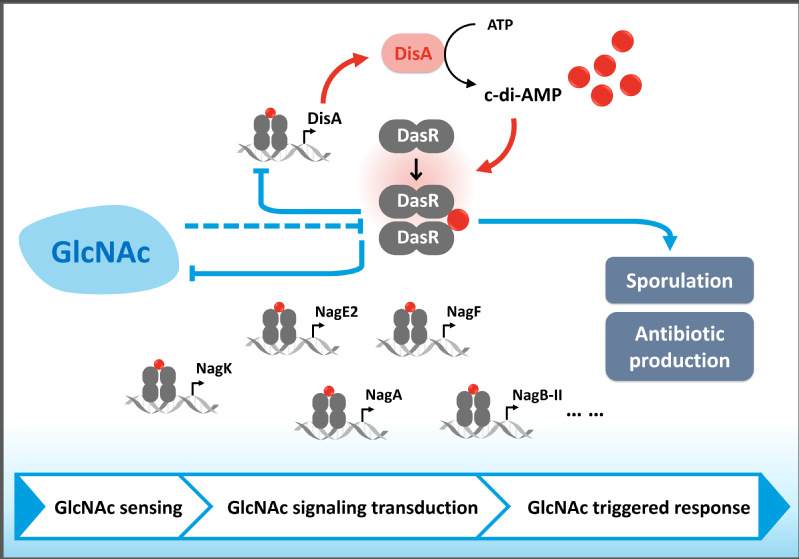
第二信使可充当“转换器”或“放大器”,将外部信号转化为相应的细胞内能量变化,从而使微生物更好地适应不断变化的环境,c-di-AMP就是一种重要的核苷酸类第二信使。c-di-AMP 由含二腺苷酸环化酶 (DAC) 结构域的蛋白质从 ATP/ADP 合成,并被 c-di-AMP 特异性磷酸二酯酶 (PDE) 降解。当受到周围环境信号(第一信使)刺激时,细菌通过调节DAC或PDE活性来控制细胞内c-di-AMP的水平。与其他核苷酸第二信使一样,不同浓度的c-di-AMP不同程度地与受体结合,调节细菌的生理功能。
叶邦策教授团队研究发现,红霉糖多孢菌GntR家族调控因子 DasR是一种新型c-di-AMP 受体蛋白,并且对 c-di-AMP合成发挥直接转录调节作用。c-di-AMP 可变构激活DasR与其靶基因的结合能力,当细胞内 c-di-AMP 水平较高时,能够触发对初级 GlcNAc 代谢和 DasR 介导的次级代谢的连续响应。此外,高水平的c-di-AMP 条件能够屏蔽GlcNAc对孢子发育和抗生素合成的不利影响,显著增强孢子分化以及红霉素的合成能力。由于c-di-AMP合成酶DisA也是DasR的调控靶标,其转录水平受到DasR的负调控,当细胞内c-di-AMP水平过高时,还可通过DasR介导的反馈调控回路维持c-di-AMP的内稳态,以避免c-di-AMP的过度累积。进一步研究以及进化分析显示,这种由c-di-AMP变构调节DasR主导的互作模式在放线菌属中尤其是链霉菌中高度保守,从而表明通过调节该细胞内的c-di-AMP水平,控制放线菌生长发育和抗生素生产,以及应对环境胁迫具有广泛的意义。
该研究发现了c-di-AMP能够调节GlcNAc信号转导的新功能,解析了c-di-AMP与转录因子DasR非共价结合调控放线菌发育与次级代谢的分子机制,揭示了除(p)ppGpp,c-di-GMP以外的又一种核苷酸类第二信使对于放线菌生理功能的调节模式,对于全面理解放线菌生理代谢与功能,提升放线菌在合成生物学、疾病治疗、药物和疫苗等生命健康领域应用提供了新的思路。
近年来,叶邦策教授团队在放线菌代谢调控与合成生物学领域取得了一系列研究成果,针对放线菌合成底盘代谢稳态与工程改造的共性科学问题和关键技术瓶颈,开展基于翻译后修饰的调控网络与合成生物系统设计方法创新研究;建立了基于翻译后修饰的代谢工程策略(PTM-ME)、核糖体工程策略(PTM-RE)、以及基因组与细胞工程策略(PTM-GE/CE),可广泛应用于目标产物的高效合成、指定蛋白质的选择性表达以及高效基因编辑等合成生物学领域(Proc Natl Acad Sci USA. 2016, 113: 6653-6658;Cell Chem Biol. 2018, 25: 1-12; ACS Synth Biol. 2019, 8: 371-380; ACS Infect Dis. 2021, 7: 927-936; Commun Biol. 2022, 5: 892; Mol Microbiol. 2023, 119:151-160; Nucleic Acids Res. 2023, 51:6870-6882)。
尤迪副教授为该论文的第一作者,叶邦策教授和尤迪副教授为共同通讯作者。该研究得到了国家重点研发计划、国家自然科学基金、上海市基础研究特区计划、华东理工大学优秀青年项目等项目支持。
论文链接:https://www.nature.com/articles/s41467-024-48063-0


