5月20日,我校药学院、生物反应器工程国家重点实验室、上海市细胞代谢光遗传学技术前沿科学研究基地赵玉政教授与上海交通大学医学院附属仁济医院蒋玉辉研究员合作,在国际权威学术期刊Nature Structural & Molecular Biology同时以Article和Research Briefing的形式,发表了标题分别为“RNAi screens identify HES4 as a regulator of redox balance supporting pyrimidine synthesis and tumorgrowth”以及“HES4 controls redox balance and supportspyrimidine synthesis and tumor growth”的研究成果,通过在活细胞水平筛选NAD(H)氧化还原调控分子并进行系列代谢功能研究,阐明HES4作为调控NAD(H)氧化还原平衡的转录因子,通过维持线粒体电子传递链和一碳循环供体平衡,促进嘧啶合成和肿瘤生长的分子机制。


氧化还原代谢是细胞代谢的核心,其中辅酶I,即氧化形式的NAD+和还原形式的NADH,参与广泛的氧化还原代谢过程,它们的含量是反映细胞氧化还原状态的关键生化指标。因此,监测活细胞内NAD(H)的动态变化,系统性地鉴定相关调控因子具有十分重要的研究意义。聚焦氧化还原代谢,研究团队在过去十余年陆续研发了NADH探针Frex(Cell Metabolism 2011,14,555)、NAD+探针FiNad(Developmental Cell 2020,53,240)、NADH/NAD+探针SoNar(Cell Metabolism 2015,21,777),NADPH探针iNap(Nature Methods 2017,14,720)、H2O2探针HyPerion(PNAS 2023,120, e2210796120)和乳酸探针FiLa(Cell Metabolism 2023,35,200),并基于此创建了氧化还原代谢的“高通量”“全景式”和“多尺度”分析方法(Nature Protocols 2016,11,1345;Nature Protocols 2018,13,2362;Nature Protocols 2024,19,1311),目前已被广泛应用于发育、生理、疾病以及生物制造等过程的代谢分析。
为了在基因组尺度系统性地刻画细胞氧化还原调控网络,研究人员首先利用能够识别NAD(H)及反映NADH/NAD+比率的高敏探针SoNar,并结合siRNA文库首次在活细胞内进行了全基因组的NAD(H)氧化还原平衡调控因子筛选(图1),发现HES4作为高分候选分子对NADH/NAD+比率起到负向调控作用,其暗示HES4功能与细胞代谢活性密切相关。
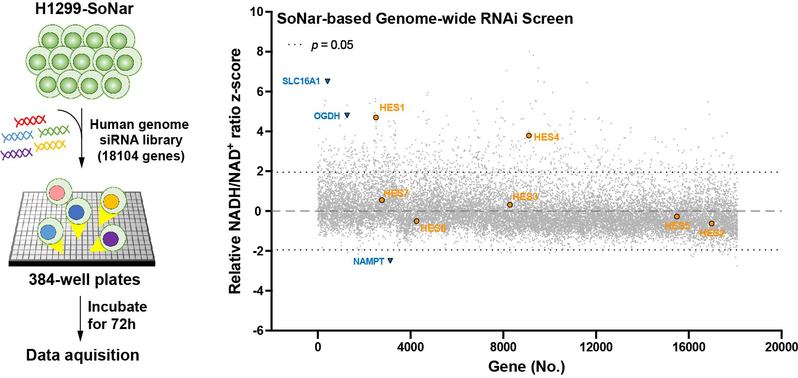
图1:靶向NAD(H)氧化还原代谢的活细胞全基因组筛选
随后,通过非靶向代谢组学分析与功能实验,研究人员发现HES4敲低会导致细胞内整体嘧啶核苷酸含量显著降低,并且是细胞生长受到抑制的关键因素;同时13C标记葡萄糖代谢流分析结果也表明HES4对细胞内嘧啶合成起到正向调控作用。代谢功能分析发现HES4通过维持线粒体辅酶Q氧化还原平衡来调控嘧啶核苷酸合成关键酶DHODH活性,同时,RNAseq分析表明一碳循环碳原子供体丝氨酸和胆碱代谢过程相关基因在HES4敲低细胞中呈现显著性富集。其中,丝氨酸脱水酶SDS和胆碱线粒体转运体SLC44A2表达量在HES4敲低细胞中呈现显著上调,并且2H标记的丝氨酸和D9标记的胆碱代谢流分析等实验证明SDS和SLC44A2表达水平变化是介导HES4调控一碳循环以及嘧啶核苷酸合成的重要环节。具体来说,一方面,SDS促进胞质丝氨酸转化成丙酮酸,抑制其进入一碳循环;另一方面,SLC44A2促进胆碱线粒体转运参与一碳循环,同时以非线粒体复合物I依赖的方式参与电子链传递,大量消耗辅酶Q,导致线粒体氧化应激和复合物I降解,因此导致NADH/NAD+比率升高以及肿瘤细胞生长抑制(图2)。
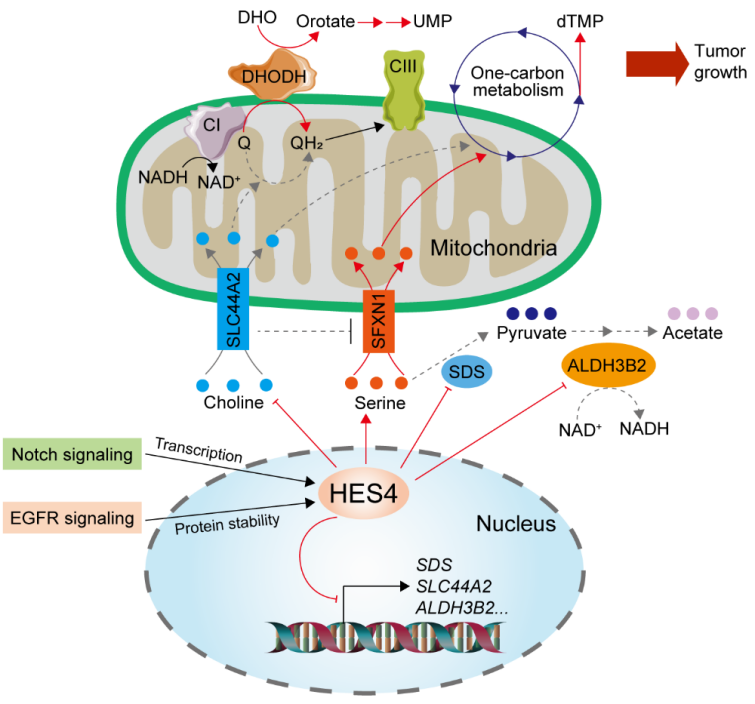
图2:揭示HES4促进嘧啶合成和肿瘤生长的分子机制
在病理相关性方面,研究人员发现HES4的表达量及代谢调控作用能够被EGFR信号通路(在肺癌等癌种中普遍存在异常激活)正向调控。机理上,EGFR信号激活能够通过抑制HES4溶酶体途径降解提高其蛋白稳定性,因而促进HES4对于下游靶点的表达调控和嘧啶合成(图2)。此外,裸鼠成瘤实验证明HES4以转录活性依赖的方式促进肿瘤生长,而敲除SDS和SLC44A2能够显著逆转HES4缺失对于肿瘤生长的抑制作用。LUAD临床样本分析显示HES4与SDS或SLC44A2表达量呈显著负相关,并且HES4表达水平与LUAD预后呈负相关,而SDS和SLC44A2表达水平与预后呈正相关。
综上所述,该研究揭示了关于HES4此前未被发现的细胞代谢重要调控功能,并结合多组学和临床样本分析详细阐明了相关调控分子机制,揭示了其潜在临床意义。此外值得提出的是,该研究中通过全基因组筛选NAD(H)氧化还原调控分子所得到的信息为后续代谢相关研究提供了有意义的架构性数据支撑。
上海交通大学医学院附属仁济医院博士后何靖和我校青年教师王傲雪为本文共同第一作者。华东理工大学赵玉政教授和上海交通大学医学院附属仁济医院蒋玉辉研究员为共同通讯作者。研究工作得到国家重点研发计划、国家自然科学基金、上海市细胞代谢光遗传学技术前沿科学研究基地、中国医学科学院细胞代谢监测成像新技术创新单元、上海市科委等经费资助。
原文链接:


