华东理工大学生物工程学院、生物反应器工程全国重点实验室教授叶邦策团队揭示了一种新型的细菌毒力调控机制,阐明了病原菌通过翻译调控优化毒力表达的分子机制,为开发针对核糖体翻译调控的新型抗菌策略提供了潜在靶点。相关研究近日发表于《核酸研究》。
沙门氏菌是典型的食源性胞内致病菌,其致病性依赖于对宿主细胞内复杂环境的快速感知与适应性调控能力。在应对环境压力时,沙门氏菌可通过双组分系统介导的转录调控以及翻译水平的动态调控,实现更快速的应激响应。目前,原核生物通过翻译后修饰介导核糖体异质性,调控蛋白质合成并进而影响其致病能力的分子机制仍不清晰。
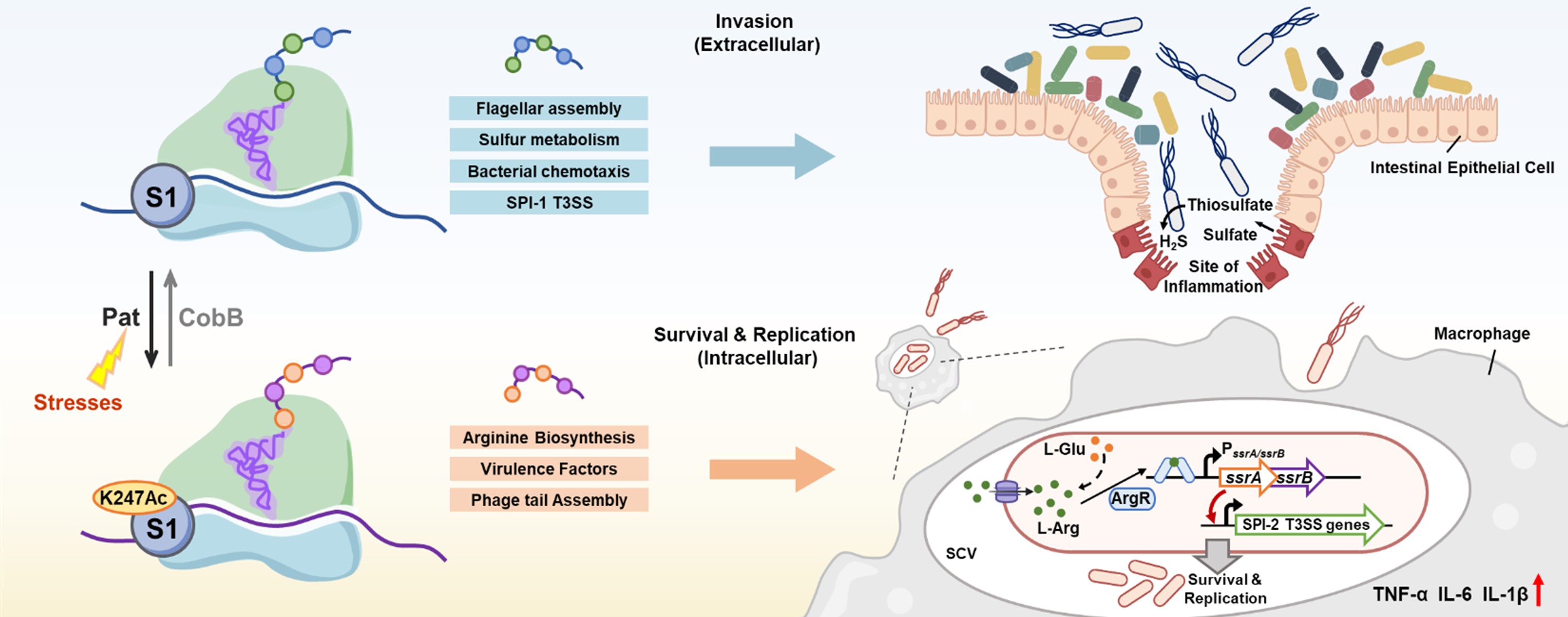
研究团队发现,鼠伤寒沙门氏菌能够动态调控核糖体蛋白S1的K247可逆乙酰化状态,从而实现翻译程序的精确重编程,适应宿主不同感染阶段的环境压力。
系列实验表明,K247乙酰化由乙酰转移酶Pat和去乙酰化酶CobB动态调控。K247非酰基化状态倾向于结合沙门氏菌鞭毛组装、硫代谢及致病岛1(SPI-1)编码的三型分泌系统(T3SS)相关的mRNA,促进细菌的早期侵袭;K247乙酰化则偏好性招募精氨酸合成及致病岛2(SPI-2)相关mRNA,其中L-精氨酸可通过激活调控蛋白ArgR进一步上调SPI-2毒力因子的表达,从而增强细菌在巨噬细胞内的存活与复制能力。
相关论文信息:https://doi.org/10.1093/nar/gkaf252


